D-Konstanz | Nicht erst seit der Corona-Pandemie sind Tests zur Eigenanwendung und patientennahe Tests ein wichtiger Baustein der Gesundheitsversorgung. Doch bei der Anwendung gibt es viele Unwägbarkeiten: Sind die Produkte so einfach gestaltet, dass Laien damit zurechtkommen? Halten sie den Bedingungen im Rettungswagen und in der Notaufnahme stand?
Erfahren Sie in diesem Beitrag,
- wie sich Selbsttests und patientennahe Tests von anderen IVD-Produkten unterscheiden,
- welche regulatorischen Besonderheiten es zu beachten gibt und
- welche Tipps Sie befolgen sollten, damit Ihre IVD sicher durch das Konformitätsbewertungsverfahren kommen.
1. Was gilt als Selbsttest und was gilt als patientennaher Test?
a) Definition Selbsttests und patientennaher Test
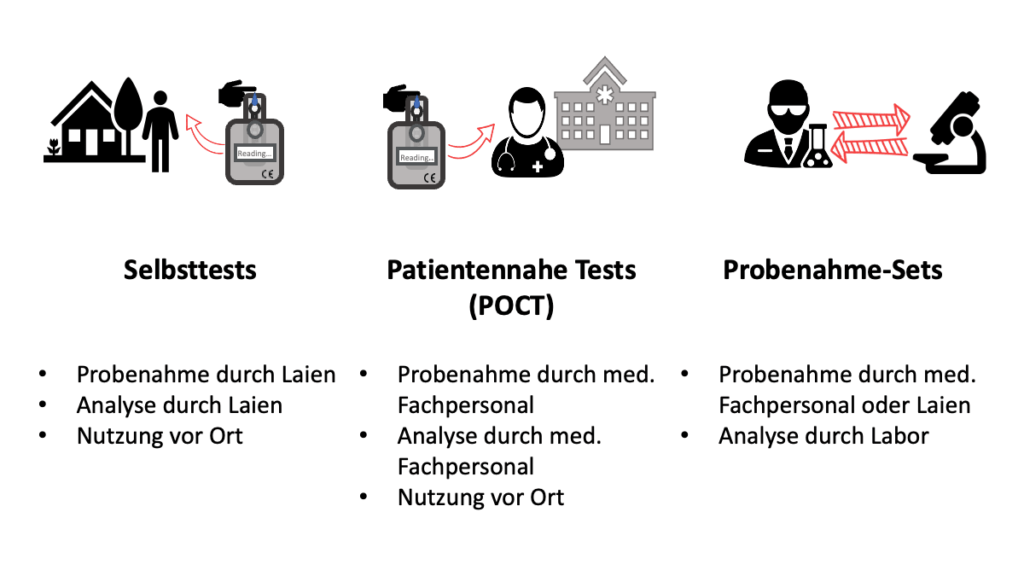
Selbsttests (auch “Produkte zur Eigenanwendung”) und patientennahe Tests (auch “Point-of-care testing”, POCT) haben viele Gemeinsamkeiten und werden daher regulatorisch ähnlich behandelt.
Selbsttests
Selbsttests nutzen Laien überwiegend in den eigenen vier Wänden. Dabei entnehmen sie die Probe selbst und führen auch die Analyse an Ort und Stelle durch.
Ein klassisches Beispiel für diese Art Tests sind Heim-Schwangerschaftstests, Cholesterintests oder Corona-Selbsttests.
Definition:
Selbsttest / Produkt zur Eigenanwendung
Unter den in der Definition der IVDR genannten “Diensten der Informationsgesellschaft” würden z. B. eine App fallen, in die Patienten die mit einem Selbsttest gemessenen Werte (z. B. Hormone im Speichel oder Urin) übertragen und die eine Handlungsempfehlung auf Basis der Auswertung dieser Daten ableitet. Die App könnte z. B. longitudinale Trends interpretieren (z. B. ausgeben, ob die Probandin gerade fertil ist oder ob gerade das Kurzzeit- oder das Langzeit-Insulin sinnvoll wäre). Die App wäre dann als ein “Dienst der Informationsgesellschaft” zu betrachten und die Software in die Kategorie “Produkt zur Eigenanwendung” einzustufen.
Patientennahe Tests
Ein patientennaher Test ist in technischer und anwendungsbezogener Hinsicht oft mit Selbsttests vergleichbar. Tätig wird bei der Durchführung des Tests jedoch nicht ein Laie, sondern Fachpersonal.
Anders als die meisten Selbsttests erfordern viele patientennahe Tests ein Analysegerät, das zwar einfach in der Handhabung ist, aber eine komplexe Technologie nutzt. Diese ist in den meisten Fällen nicht nur zu komplex, um von Laien verwendet zu werden, sondern auch zu teuer in der Anschaffung.
Andere patientennahe Tests nutzen ein fertiges Test-Kit, das einem Selbsttest ähnelt. Die Probe wird durch medizinisches Personal wie Ärztinnen und Ärzte, Rettungspersonal etc. entnommen und nicht durch die Patienten selbst. Medizinisches Fachpersonal führt bei patientennahen Tests auch die Analyse der Probe durch.
Beispiele sind etwa Corona-Schnelltests in Testzentren oder Blutgasanalysen in der Notaufnahme und der Neonatalogie sowie der CRP-Test in der Kinderarztpraxis zur Feststellung, ob eine Infektion vorliegt.
Weiterführende Informationen
Der Trillium-Verlag hat eine Liste von POC-Systemen, die ein Analysegerät erfordern, erstellt.
Definition:
Patientennahe Tests
b) Abgrenzung zu Probenahme-Sets
Bei Probenahme-Sets erfolgt im Normalfall die Entnahme der Probe durch eine medizinische Fachkraft (wie bei patientennahen Tests), z. B. in einer Arztpraxis, und in Ausnahmefällen durch den Patienten selbst (wie bei Selbsttests). Im Gegensatz zu Selbsttest und patientennahen Tests wird die Analyse bei Probenahme-Sets aber nicht an Ort und Stelle durchgeführt, sondern die entnommene Probe wird in ein medizinisches Labor gesendet. Dieses führt die eigentliche Diagnostik durch.
Der Hauptunterschied liegt damit in der Analyse: Bei Selbsttests und POCT erfolgt diese an Ort und Stelle. Bei Probenahme-Sets erfolgt die Analyse durch ein zentralisiertes Labor.
Wo es in regulatorischer Hinsicht zwischen Selbsttests und patientennahen Tests große Gemeinsamkeiten gibt, gilt für Probenahme-Sets das Gegenteil. Sie werden regulatorisch stark abweichend von den anderen beiden Test-Kit-Formen gehandhabt.
Beispiele für Selbsttests, patientennahe Tests und Probenahme-Sets anhand Tests auf eine Infektion mit SARS-CoV-2:
- Selbsttest: Antigen-Test zur Eigenanwendung, gekauft z. B. im Supermarkt, der Apotheke oder online
- Patientennaher Tests (POCT): Antigen-Schnelltest in einem sog. Corona Testzentrum
- Probenahme-Set: Einem niedergelassenen Arzt durch ein Labor bereitgestelltes Entnahme-Set mit Rücksendebox zum Versand der Probe an das Labor zur Durchführung eines PCR-Tests auf SARS-CoV-2 RNA
2. Regulatorische Anforderungen an Selbsttests und patientennahe Tests
Es gibt zahlreiche regulatorische Anforderungen, die sowohl für Selbsttests als auch füt patientennahe Tests gelten, und einige wenige, die jeweils nur für die eine oder andere Art von Test gelten.
a) Regulatorische Anforderungen, die sowohl für Selbsttests als auch für patientennahe Tests gelten
Die regulatorischen Anforderungen für beide Testarten finden sich in der EU-Verordnung über In-vitro-Diagnostika 2017/746 (IVDR).
Besondere Anforderungen an Gebrauchstauglichkeit
Da Selbsttests und patientennahe Tests an Ort und Stelle und damit nicht in einer kontrollierten Laborumgebung genutzt werden, bestehen besondere Anforderungen an die Gebrauchstauglichkeit der Tests (vgl. z. B. Anhang I 19. IVDR). Das gilt insbesondere für die von medizinischen Laien verwendeten Selbsttests.
So müssen etwa
- Usability-Studien durchgeführt werden (Anhang I 9.4.)
Dabei muss z. B. bei Selbsttests nachgewiesen werden, dass Laien zuverlässige Ergebnisse erzielen können. - Usability insbesondere in der Anwendungsumgebung geprüft werden (Anhang I 9.4.)
Kommen unterschiedlichste Umgebungen für den Einsatz des Tests infrage, müssen Hersteller nachweisen, dass der Test in den vorgesehenen Umgebungen zuverlässig nutzbar ist. Kann der Test etwa im Krankenwagen genutzt werden, in dem es zu Erschütterungen und Temperaturschwankungen kommen kann, muss auch die Prüfung in dieser Umgebung erfolgen. - alle einzelnen Produkte eine Gebrauchsanweisung haben
Nach Anhang I 20.1. e) IVDR muss jedem Produkt eine Gebrauchsanweisung beigefügt sein. Liegen einer Großpackung also etwa 10 Tests bei, muss jedem dieser Tests eine Gebrauchsanweisung beigefügt sein, anstatt nur eine Gebrauchsanweisung für die ganze Großpackung. Das gilt selbst dann, wenn mehrere Produkte an einen einzigen Anwender geliefert werden. Außerdem muss in der Gebrauchsanweisung der vorgesehene Anwender ausgewiesen sein (Anhang I 20.4.1. e) IVDR).
- die Gebrauchsanweisungen in Papierform vorliegen (Anhang I 20.1. f) IVDR)
Kennzeichnung
Bei der Kennzeichnung der Produkte sind ebenfalls Besonderheiten zu beachten:
- Leicht verständlich
Angaben der Kennzeichnung und Gebrauchsanweisung müssen laut Art. 10 Abs. 10 IVDR leicht verständlich sein (besonderes Augenmerk liegt auf Gebrauchstauglichkeit) und in der oder den Amtssprachen des Mitgliedstaats sein, in dem das Produkt bereitgestellt wird. - Hinweis auf Eigenanwendung bzw. patientennahe Testung
Nach Anhang I 20.2. q) IVDR muss die Kennzeichnung einen Hinweis darauf enthalten, dass das Produkt für die Eigenanwendung bzw. für patientennahe Testung vorgesehen ist.
Wie dieser Hinweis auszusehen hat, ist noch nicht genau definiert. Die ISO 15223-1 etwa führt hierzu noch kein Symbol auf. Daher sollte auf jeden Fall in Textform „device for self-testing“ entsprechend der Definition in Artikel 2 IVDR angegeben werden bzw. bei POCT „for near-patient testing“. Dieses Vorgehen ist auch vom Branchenverband MedTech Europe anerkannt. Die Vorschläge für Symbole hat MedTech Europe in einem PDF zusammengestellt.
Beim Antrag auf Bewertung (Konformitätsbewertungsverfahren)
- Usability-Nachweis bei Antrag auf Bewertung der TD
Auch bei der Beantragung der Bewertung der Technischen Dokumentation durch eine Benannte Stelle liegt der Fokus auf Gebrauchstauglichkeit (Usability): So muss nach Art. 48 Abs. 3, 7 und 9 nach Anhang IX 5.1. IVDR die Bewertung der Technischen Dokumentation gesondert beantragt und dieser Beantragung Gebrauchstauglichkeitsstudien beigefügt werden. Die Technische Dokumentation muss auch Nachweise enthalten, dass Laien oder Fachpersonal das Produkt in jedem Fall auch unter Stress anwenden können (Anhang II 3.1. e) IVDR).
- Usability-Nachweis bei Antrag auf Bewertung nach Baumusterprüfung
Ähnliches gilt nach Anhang X 2. IVDR auch für Anträge auf Konformitätsbewertung durch eine Benannte Stelle auf der Grundlage einer Baumusterprüfung. Diese enthalten zusätzlich:- Testberichte, einschließlich der Ergebnisse von Gebrauchstauglichkeitsstudien
- Angaben, die die Eignung des Produkts im Zusammenhang mit seiner Zweckbestimmung zur Eigenanwendung oder für patientennahe Tests belegen
EUDAMED
Selbsttests und patientennahe Tests müssen nach Anhang VI 2.14 IVDR in der EUDAMED-Datenbank als Produkt zur Eigenanwendung oder für patientennahe Tests registriert werden.
b) Spezielle Anforderungen an Selbsttests
Zusätzlich zu den Anforderungen in Punkt a) gelten für Selbsttests die folgenden Anforderungen:
Anforderungen nach IVDR
Kennzeichnungen und Gebrauchsanweisung
- Name eindeutig
Der Name von Produkten zur Eigenanwendung darf nicht auf eine andere als die vom Hersteller festgelegte Zweckbestimmung hinweisen (Anhang I 20.2 IVDR). Das Produkt muss also eindeutig benannt sein.
Beispiel: Ein Test auf Corona für Personen ab 12 Jahre darf nicht “Coronatest für alle Altersgruppen” genannt werden, da er nicht für alle Altersgruppen gedacht ist.
- Kennzeichnung und Gebrauchsanweisung mit bestimmten Angaben
Auf der Kennzeichnung (nicht nur in der Gebrauchsanweisung!) von Produkten zur Eigenanwendung muss nach Anhang I 20.2. u) IVDR Folgendes angegeben werden:- die Art der für die Durchführung des Tests erforderlichen Probe(n) (z. B. Blut, Urin oder Speichel)
- ob zusätzliche Materialien für das ordnungsgemäße Funktionieren des Tests benötigt werden
- Kontaktdaten für weitere Beratung und Unterstützung.
- Zusätzliche Anforderungen an die Gebrauchsanweisung (Anhang I 20.4.2 IVDR)
Außerdem gibt es die folgenden zusätzlichen Anforderungen an die Gebrauchsanweisungen für Selbsttests:- Ausreichende Angaben, um den Anwender in die Lage zu versetzen, das Produkt einzusetzen und das/die vom Produkt erzeugte(n) Ergebnis(se) zu verstehen
- Eine für Laien verständliche Zweckbestimmung
- Eine für Laien verständliche Ergebnisdarstellung
- Angaben zu Maßnahmen abhängig vom Testergebnis (z. B. Intervention (etwa Quarantäne), Handlungsempfehlung (bestimmte Allergene meiden) oder Entlastung (negatives Testergebnis und damit keine Einschränkungen))
- Angaben zu Einschränkungen (beispielsweise Alter, Geschlecht, Menstruation, Infektionen, sportliche Betätigung, Fasten, Diät oder Einnahme von Arzneimitteln)
- Weitere Hinweise, z. T. Mitgliedstaaten-spezifisch
Klassifizierung
Selbsttests (Produkte zur Eigenanwendung) fallen nach Anhang VIII 2.4. a) IVDR in die Klasse C. Ausgenommen sind davon:
- Schwangerschaftstests
- Fruchtbarkeitstests
- Cholesterintests
- Produkte zum Nachweis von Glukose, Erythrozyten, Leukozyten und Bakterien im Urin
Diese fallen unter Klasse B.
Leistungsstudien
Im klinischen Leistungsstudienplan müssen Hersteller Angaben zum Standort der Durchführung einer klinischen Leistungsstudie und zur Anzahl der einbezogenen Laien machen (Anhang XIII 2.3.2 IVDR). Insbesondere ist es hier wichtig, ob Laien in den Leistungsstudien die richtigen Rückschlüsse ableiten können (vgl. Anhang I 9.4.a IVDR).
Weitere Regelungen
- Laut MPAV (Medizinprodukte-Abgabeverordnung) §3 (2) 3 muss bei Abgabe von Selbsttests an Laien bei Bedarf eine fachliche Beratung gewährleistet werden.
- Nach MPAV §1 und §2 sind bestimmte Tests (insbesondere, wenn sie verschreibungspflichtige Bestandteile enthalten) verschreibungspflichtig und apothekenpflichtig.
Normen
- Für das Labeling von Selbsttests sind DIN ISO 18113-4 und ISO 18113-5 zu beachten.
- ISO 20417:2021 zu Begleitmaterialien geht u. a. auf Besonderheiten bei Laien-Anwendern ein.
- Allgemeine Hinweise zu Selbsttests: DIN EN 13532:2002-08 – Allgemeine Anforderungen an In-vitro-Diagnostika zur Eigenanwendung
Diese Norm bietet derzeit keinen sehr großen Mehrwert. Alternativ können sich Hersteller an der IEC 62366 und der ISO 14971 orientieren, wenn sie die Prinzipien an den Fall “Selbsttests” anpassen (Brainstorming des RM-Teams anhand der Produkteigenschaften).
Die DIN EN 13532:2002-08 ist im Harmonisierungsmandat der EU enthalten und soll bis zum 27. Mai 2024 harmonisiert werden. Eine hilfreiche Überarbeitung könnte also bald erfolgen.
c) Spezielle Anforderungen an patientennahe Tests
IVDR
Die speziellen Anforderungen der IVDR an patientennahe Tests beziehen sich auf die Klassifizierung: Produkte zur Verwendung in patientennahen Tests fallen nicht unter eine einheitliche Klasse (wie dies bei Selbsttests der Fall ist). Stattdessen müssen sie je nach Zweckbestimmung klassifiziert werden (Anhang VIII 2.4. b) IVDR).
Normen
- Die teils umfangreichen CLSI POCT-Standards für Point-of-Care-Tests: POCT4-A2 Vol. 26 No. 30 beispielsweise liefert hilfreiche Überlegungen zur Abgrenzung der Verantwortlichkeiten der professionellen User, Methodik der Testung, Sicherheit und Entsorgung, Kalibrierung sowie Dokumentation.
- ISO/TS 22583:2019: Guidance for supervisors and operators of point-of-care testing (POCT) devices
- DIN EN ISO 22870:2017-04: Patientennahe Untersuchungen (point-of-care testing, POCT). Diese wird bald durch die neue ISO 15189 ersetzt.
- Medizinische Labore, die patientennahe Tests anbieten, sollten außerdem den Entwurf der EN ISO 15189:2021-11-15 beachten.
Weiterführende Informationen
Zur weiteren Recherche ist das Buch POCT – Patientennahe Labordiagnostik; Peter B. Luppa · Ralf Junker Hrsg.; 3. Auflage empfehlenswert.
3. Tipps und Hinweise
Damit Ihre Selbsttests und POCT ohne Schwierigkeiten durch das Konformitätsbewertungsverfahren kommen, haben wir die folgenden Tipps für Sie:
Tipp 1: Legen Sie die Zweckbestimmung sauber fest
Für die Leistungsbewertung sollte die Zweckbestimmung sauber festgelegt werden.
Es ist ein großer Unterschied, ob ein Test dem Nachweis eines Biomarkers dient oder dessen Ausschluss. Beim Nachweis geht man davon aus, dass Patienten positiv sind (Symptome oder Risikogruppe). Beim Ausschluss geht man von gesunden Testpersonen aus. Daraus leiten sich Kriterien für die Leistungsbewertung ab: Einerseits die Kriterien, nach denen Probanden für den Test in Frage kommen oder nicht, andererseits die Akzeptanzkriterien für die Leistung, z. B. die erforderliche diagnostische Sensitivität und Spezifität.
Weitere Informationen finden Sie in unserem Beitrag Fallzahlplanung.
Tipp 2: Legen Sie ein besonderes Augenmerk auf die Gebrauchstauglichkeit
Allein aus regulatorischer Sicht sollte die Gebrauchstauglichkeit bei Selbsttests und patientennahen Tests weit oben auf der Prioritätenliste stehen. Immerhin macht die IVDR hier zahlreiche Vorgaben (s. o.). Doch auch aus rein praktischer Sicht sollte in die Überlegungen von Herstellern einfließen, dass ihr Produkt für Laien und/oder die Anwendung in unkontrollierbaren Umgebungen gedacht ist.
Die Anwendung vieler Selbsttests und POCT ist nur mit einer Einweisung zu verstehen. Daher ist eine sichere und effektive Anwendung nur mit einer guten Gebrauchsanweisung und ggf. einem Training möglich. Hersteller sollten also besondere Sorgfalt darauf legen, die Gebrauchsanweisung und ggf. zusätzlich eine Kurzanleitung (Quick Reference Guide) gebrauchstauglich zu gestalten.
Hierzu ist auch der Usability-Engineering-Prozess der IEC 62366-1 zu beachten.
Weiterführende Informationen
Weitere Informationen erhalten Sie in unserem Beitrag zum Thema Gebrauchsanweisungen.
Tipp
Kontaktieren Sie unsere Usability-Expert:innen. Sie werden Ihnen mit einer schnellen formativen Bewertung helfen, Probleme mit der Gebrauchstauglichkeit früh zu finden und so Nachbesserungen und Probleme bei der Zulassung zu vermeiden.
Tipp 3: Kalkulieren Sie die Nutzer beim Risikomanagement ein
Bei Selbsttest besteht ein hohes Potenzial für vorhersehbaren Missbrauch. Bei diesen besteht auch ein hohes Risiko durch die Nutzung in unvorhergesehenen Situationen bzw. an unvorhergesehenen Orten.
Bei POCT ist dagegen manchmal ein Wechsel in der Nutzergruppe möglich, beispielsweise von Krankenpfleger:innen zu Altenpfleger:innen oder pharmazeutischer Assistenz.
Hersteller müssen diese Risiken systematisch analysieren und beherrschen und dies in der Risikomanagementakte dokumentieren.
Weiterführende Informationen
Weitere Informationen erhalten Sie im Beitrag zu Risikomanagement.
Tipp 4: Prüfen Sie, ob sich verschiedene Kits als Gruppe bewerten lassen
Gibt es bei vergleichbaren Produkten starke Überschneidungen des Benutzungsszenarios, dann sollten Hersteller prüfen, ob sie diese als Gruppe in einer Usability-Studie zusammenfassen können. Doch Vorsicht: Die Abgrenzung, was zusammengefasst und was individuell getestet werden kann, ist oft schwierig. Stellen Sie daher sicher, dass die Szenarien auch wirklich identisch sind und die jeweilige Zweckbestimmung nicht doch noch weitere Risiken im Nutzungsszenario birgt. Erkundigen Sie sich im Zweifel, z. B. bei den Expertinnen und Experten des Johner Instituts.
Beispiel: Bietet ein Hersteller diverse Lateral Flow Tests als Allergietests an, die alle nach demselben Testprinzip und Testprotokoll ablaufen, und weisen die Nutzergruppen und die Nutzungsumgebung die gleichen wesentlichen Charakteristiken auf, ist das Anwendungsszenario identisch und kann für mehrere Produkte einer generischen Produktgruppe bewertet werden.
5. Fazit
Da Hersteller nur schwer absehen können, wie und wo Nutzer Proben bei Selbsttests und patientennahen Tests entnehmen und analysieren, ist eine einfache Handhabung der Kits unerlässlich. Je weniger die Nutzer beachten müssen (und damit falsch machen können), desto zuverlässiger sind die Ergebnisse.
Hersteller von Selbsttests und patientennahen Tests sollten daher unbedingt ein starkes Augenmerk auf die Usability legen. Auch das Begleitmaterial (insbesondere die Gebrauchsanweisung) sollte in jedem Fall auch für alle vorgesehenen Nutzer und selbst unter stressigen Bedingungen verständlich sein. Entsprechende Usability-Studien sollten Hersteller daher unbedingt früh und im nötigen Umfang einplanen.
(Quelle: Blog Johner Institut, 14.06.2022)
